Човечеството спешно се нуждае от ефективни лекарства срещу COVID-19, но кой е най-бързият начин да бъдат намерени?
Подход, приличащ на много дълъг пас напред, който се прави като последен опит (понякога отчаян) за успех и е известен в американския футбол като „Аве, Мария“ (Hail Mary), е използването на лекарства, които вече са доказали своята ефективност при други вируси (като хепатит С или Ебола).
Друг подход към тази задача е да бъдем рационални и да се насочим към протеини на вируса с цел да прекъснем жизнения му цикъл, съобщават в New England Journal of medicine д-р Джери Спаркс и д-р Джереми Смит от Университета на Тенеси (Национален лабораторен център по молекулярна биофизика на Oak Ridge, отдел Бионауки и Национална лаборатория Oak Ridge, Катедрата по биохимия и клетъчна и молекулярна биология).
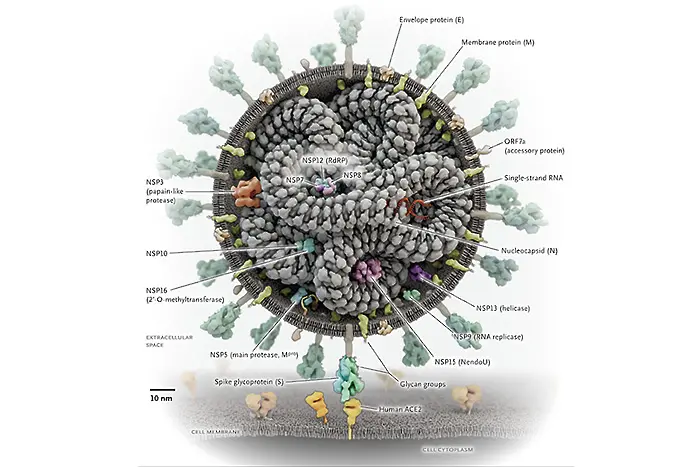
Вирусът SARS-CoV-2 и неговите протеини
Въпреки че всички протеини на SARS-CoV-2 са потенциални мишени, срещу някои от тях вероятно ще бъде по-лесно намирането на лекарство, отчасти защото играят основна роля в жизнения цикъл на вируса и също така защото нямат аналози в човешкия организъм.
Приблизително 25 протеина са необходими на вируса да зарази човек и да започне да се размножава (репликация). Сред тях са: прословутият протеин, който прилича на шипче и атакува човешкия ангиотензин-конвертиращ ензим в началния етап на инфекцията; две протеази, които разцепват вирусни и човешки протеини; РНК полимеразата, която синтезира вирусна РНK и РНК-разцепващата ендорибонуклеаза.
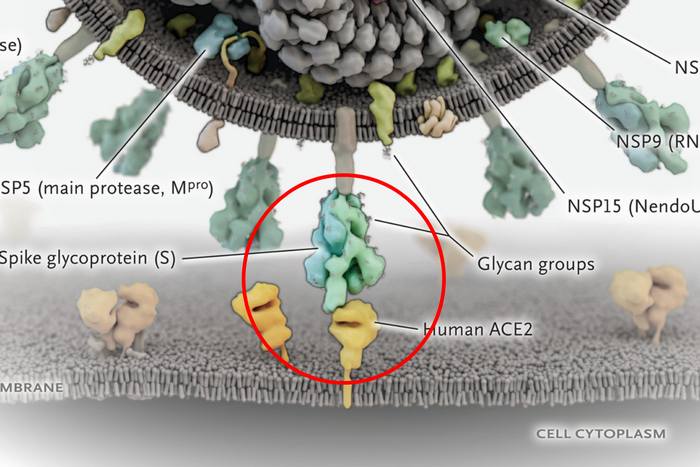
Намирането на лекарства, които могат да се свържат с тях и да им попречат да функционират, е логичният път, по който работят много изследователски лаборатории.
Един подход за постигане на тази цел включва природния модел „ключ-ключалка“ с използване на изчислителни структури. В този процес компютрите „свързват” в триизмерен модел дадено пробно съединение с протеиновата мишена на вируса. И изчисляват афинитета на свързване, като определят количествено взаимодействието им. След това най-високо класираните съединения се тестват експериментално, за да се провери дали наистина се свързват и имат необходимите ефекти като спиране на вирусна инфекциозност върху клетки и в животински модели.
На тази база беше открито лекарството нелфинавир през 90-те години за лечение на ХИВ. За съжаление по онова време използването на изчислителни структури беше сравнително неефективно: изчисленията бяха неточни, а компютрите - толкова слаби, че само около 100 съединения можеха да бъдат свързани едновременно.
Нещо повече, както лекарството, така и протеинът трябваше да бъдат неподвижни (ригидни) в момента на влизане на „ключа в ключалката“ - твърдо свързване (твърд докинг), което не е възможно в реалния живот.
От 90-те години насам силата на суперкомпютрите се увеличи поне милион пъти. Днес може да се извърши такова твърдо свързване на над милиард съединения. Може да се направи и виртуален скрининг, който бързо да идентифицира много добре свързващите се съединения. Освен това могат да се извършват молекулярно-динамични симулации за изчисляване на вътрешните протеинови движения, а кандидат-лекарството да бъде проверено чрез процес, който използва различните форми, образувани от мястото на свързване в процедура, известна като „ансамбъл докинг“. Този подход е по-реалистичен от твърдото свързване.
Съвременните суперкомпютри като Summit в Националната лаборатория Oak Ridge, който в момента е най-мощният в света, извършват масово паралелно обработване и едновременно с това - много изчисления. С помощта на Summit за един ден може да се получи цялостен симулационен модел на дадена протеинова мишена на SARS-CoV-2, което би отнело месеци на един типичен компютърен клъстер.
Какво се случва сега? Трудоемкият класически път за откриване и одобрение на нови лекарства, който продължава с десетилетия, едва ли би могъл да бъде подходящ в настоящата пандемия. Пренареждането на съществуващите лекарства предлага потенциално бърз механизъм за внедряване, тъй като техните профили за безопасност са известни.
В средата на февруари беше изготвен предварителен доклад, в който 8000 съединения бяха класирани според афинитета им на свързване към S протеина (шипчестия протеин) на вируса. Съединенията, които са класирани на първите места, се тестват за активност срещу живия вирус, съобщават Джери Спаркс и Джереми Смит.
Днес, знанията за вируса се променят с всеки ден, публикуват се много нови експериментални триизмерни структури на S протеина и на други вирусни мишени, а това изисква симулациите и свързването (докинга) да бъдат прецизирани и повторени. Използва се и изкуствен интелект за прогнозиране на свързването. Създават се различни видове експериментални лабораторни скринингови програми, които използват както суперкомпютри, така и огромни облачни изчислителни ресурси. Нищо от гореизброеното не гарантира успех в рамките на даден период от време, но комбинацията от рационалност, научен поглед и изобретателност с най-мощните налични инструменти би трябвало да даде най-добрия резултат, заключават учените.
Подкрепете ни
Уважаеми читатели, вие сте тук и днес, за да научите новините от България и света, и да прочетете актуални анализи и коментари от „Клуб Z“. Ние се обръщаме към вас с молба – имаме нужда от вашата подкрепа, за да продължим. Вече години вие, читателите ни в 97 държави на всички континенти по света, отваряте всеки ден страницата ни в интернет в търсене на истинска, независима и качествена журналистика. Вие можете да допринесете за нашия стремеж към истината, неприкривана от финансови зависимости. Можете да помогнете единственият поръчител на съдържание да сте вие – читателите.
Подкрепете ни